Una revolución silenciosa en las pruebas de fármacos: la ruptura de la FDA con los modelos animales promete una bioproducción más rápida, barata y ética
La Administración de Alimentos y Medicamentos de EE. UU. (FDA, por sus siglas en inglés) anunció hoy su intención de eliminar gradualmente las pruebas obligatorias en animales para los anticuerpos monoclonales y otros fármacos. La decisión, que ha tardado años en tomarse y que tanto defensores de la ética como científicos clínicos han reclamado durante mucho tiempo, pone en marcha una transición drástica hacia métodos más predictivos, eficientes y relevantes para los humanos para evaluar la seguridad y la eficacia de los fármacos.

"Es el desmantelamiento de una suposición científica centenaria", dijo un analista regulatorio familiarizado con el proceso. "Nos estamos alejando de los modelos animales y entrando en el campo de la biología computacional y los sistemas humanos diseñados. Las implicaciones son enormes".
Del laboratorio de animales al chip de silicio: la hoja de ruta innovadora de la FDA
Una nueva era de la toxicología
La hoja de ruta recién presentada por la FDA describe el uso de Nuevas Metodologías de Enfoque (NAMs), un conjunto de herramientas que van desde modelos computacionales basados en inteligencia artificial hasta organoides derivados de humanos y tecnologías de órganos en chip. Estas herramientas tienen como objetivo replicar la biología humana con mucha mayor fidelidad que el estándar actual: las pruebas en animales.
Las Nuevas Metodologías de Enfoque (NAMs) se refieren a una variedad de técnicas modernas utilizadas principalmente en toxicología y evaluación de la seguridad. Abarcan métodos in vitro, in silico y otros métodos no animales desarrollados como alternativas para reemplazar, reducir o refinar los procedimientos tradicionales de pruebas en animales.
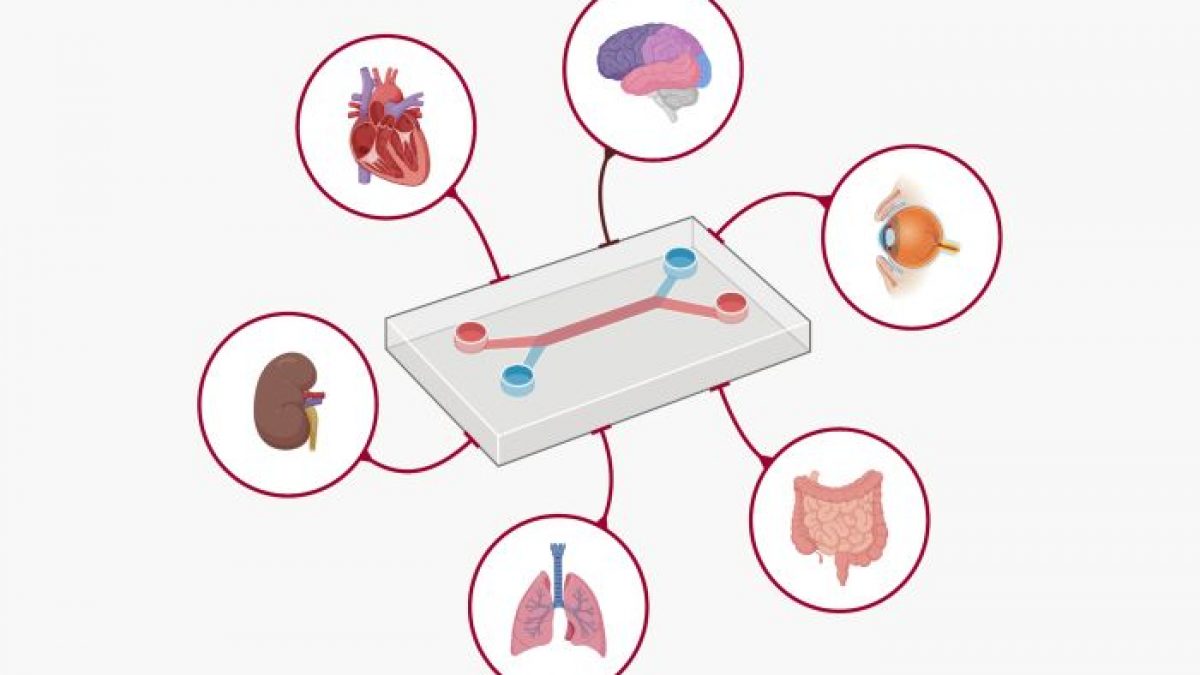
Los componentes clave de la política incluyen:
- Fomento inmediato de los datos de las NAMs en las solicitudes de nuevos fármacos en investigación (IND).
- Aceptación de datos de seguridad humana del mundo real de reguladores internacionales comparables.
- Programas piloto que comienzan este año, que permiten a desarrolladores seleccionados presentar anticuerpos monoclonales evaluados principalmente con métodos no animales.
- Incentivos regulatorios, incluidas revisiones simplificadas, para los desarrolladores que presenten datos validados de pruebas no animales.
"Esta es una situación en la que todos ganan", dijo un toxicólogo sénior. "Los fármacos llegan a los pacientes más rápido. Los costes de desarrollo son más bajos. Y nos alejamos de los modelos animales éticamente problemáticos y, a menudo, poco predictivos".
El statu quo: defectuoso, caro y éticamente cuestionable
Los costes ocultos de las pruebas en animales
Durante décadas, las pruebas en animales han sido el estándar de oro regulatorio. Desde ratones y ratas hasta perros y primates, se han utilizado animales para simular las respuestas humanas a los fármacos en investigación. Pero estos modelos a menudo se quedan cortos. Una molécula que funciona bien en un roedor puede comportarse de manera impredecible en humanos, una brecha de traducción que ha contribuido a innumerables fracasos de ensayos clínicos en etapas avanzadas y retiradas de seguridad posteriores a la aprobación.

| Métrica | Estadística/Hallazgo | Fuente/Contexto |
|---|---|---|
| Tasa de fracaso general de los ensayos clínicos (después de las pruebas preclínicas) | Aproximadamente del 90% al 92% de los fármacos candidatos que entran en ensayos clínicos en humanos no obtienen la aprobación regulatoria. | Múltiples fuentes citan este rango, incluyendo BIO, Cruelty Free International y documentos académicos que hacen referencia a datos de la industria (por ejemplo, Sun et al., 2022). |
| Razones principales del fracaso en los ensayos clínicos | Falta de eficacia clínica (40-50%), problemas de toxicidad/seguridad inmanejables (aprox. 30%), propiedades farmacológicas deficientes (10-15%). | Análisis citado en Sun et al. (2022) y corroborado por hallazgos de que más de la mitad de los fracasos de la Fase II/III se deben a la falta de eficacia. |
| Predictibilidad de los modelos animales | Las altas tasas de fracaso en humanos (por ejemplo, el 92%) se producen a pesar de los resultados prometedores en las pruebas preclínicas, incluidas las pruebas en animales. | Cruelty Free International, PETA, Humane Society International y revisiones académicas destacan la desconexión (brecha de traducción). |
| Tasa de éxito por fase clínica (datos aproximados de 2011-2020) | Fase I: ~52% de éxito; Fase II: ~29% de éxito; Fase III: ~58% de éxito. | Los datos informados por BIO (Biotechnology Innovation Organisation) indican que la Fase II es un importante cuello de botella. |
| Tasa de fracaso por área terapéutica (datos aproximados de 2011-2020, al entrar en los ensayos) | Urología (~96% de fracaso), Cardiología (~95% de fracaso), Oncología (~95% de fracaso), Neurología (~94% de fracaso). | Los datos informados por BIO muestran tasas de fracaso muy altas en diferentes áreas de enfermedades. |
La "brecha de traducción" en el desarrollo de fármacos se refiere a la dificultad significativa y la alta tasa de fracaso que se encuentra al intentar traducir descubrimientos prometedores de la ciencia básica del laboratorio ("banco") en tratamientos eficaces y seguros para los pacientes humanos ("cama"). Un desafío principal es que los modelos preclínicos, particularmente los estudios en animales, a menudo no predicen con precisión cómo funcionará un fármaco potencial en humanos.
Además, las pruebas en animales son notoriamente caras y lentas. Las estimaciones sugieren que pueden añadir meses o incluso años al calendario de desarrollo e inflar los costes de I+D en cientos de millones de dólares.
Tabla: Comparación de costes y plazos para las pruebas tradicionales en animales frente a las NAMs en el desarrollo preclínico de fármacos
| Aspecto | Pruebas tradicionales en animales | Nuevas metodologías alternativas (NAMs) |
|---|---|---|
| Coste | 2–4 millones de dólares por estudio; alta variabilidad | Costes más bajos debido a la automatización y la eficiencia |
| Plazo | 4–10 años para estudios exhaustivos | Resultados rápidos (de semanas a meses) |
| Eficiencia | Valor predictivo limitado para la biología humana | Alto rendimiento y relevante para los humanos |
| Desafíos | Necesario para evaluaciones complejas a largo plazo; requisitos regulatorios | No puede replicar completamente sistemas complejos; adopción regulatoria limitada |
Luego está el cálculo ético. Cada año, decenas de miles de animales se utilizan en el desarrollo de fármacos en EE. UU. Muchos de estos experimentos implican procedimientos invasivos sin posibilidad de recuperación. Bajo esta luz, la medida de la FDA no es solo un salto científico, sino un punto de inflexión ético.
Pruebas relevantes para los humanos: precisión sin dolor
Los modelos de IA y los organoides toman el centro del escenario
¿Qué reemplaza al modelo anterior? Una poderosa confluencia de tecnologías que antes se consideraban futuristas:
-
Toxicología de la Inteligencia Artificial: Las herramientas de IA entrenadas con millones de puntos de datos ahora pueden simular cómo se comportan los fármacos en los tejidos humanos, prediciendo los efectos secundarios y la toxicidad de los órganos con una precisión cada vez mayor. Algunos modelos pueden mapear la distribución de anticuerpos monoclonales a través del cuerpo humano in silico, sin un solo animal de laboratorio.
-
Organoides y sistemas de órganos en chip: Estos tejidos humanos cultivados en laboratorio, versiones diminutas de órganos como el hígado, el corazón o el sistema inmunitario, ofrecen una ventana directa a la biología humana. Los investigadores ahora pueden observar cómo los fármacos afectan a las células humanas reales en tiempo real.
Un adoptante temprano en una empresa de biotecnología de tamaño mediano señaló: "En nuestro programa reciente de anticuerpos monoclonales, los modelos de organoides detectaron hepatotoxicidad que nuestros modelos de rata pasaron por alto por completo. Eso no es solo eficiencia. Eso es seguridad del paciente".
Quién gana, quién pierde: una industria reequilibrada
Ganadores: Innovadores impulsados por la tecnología y biotecnologías ágiles
Para las empresas que han invertido durante mucho tiempo en pruebas relevantes para los humanos, la decisión de la FDA es una reivindicación y un claro viento de cola. Estos incluyen:
- Biotecnologías que aprovechan los sistemas de organoides e in vitro, capaces de reducir sus plazos preclínicos hasta en un 40%.
- Desarrolladores de plataformas de IA, que crean modelos de toxicología predictiva que las principales farmacéuticas ahora se apresuran a licenciar.
- Organizaciones de Investigación por Contrato (CRO) que pasaron temprano de las pruebas en animales a los ensayos basados en células y las simulaciones de silicio.

Los inversores ya se han dado cuenta. "Vemos esto como un viento de cola secular de cinco años para cualquier actor involucrado en pruebas alternativas", dijo un gestor de cartera de un fondo de cobertura centrado en las ciencias de la vida.
Perdedores: Empresas de pruebas tradicionales en animales en riesgo
El impacto en las CRO tradicionales de pruebas en animales es más aleccionador. Los informes indican una caída del 28% en las acciones de Charles River Laboratories, un referente para la industria de pruebas en animales, tras el anuncio de la FDA. Estas empresas ahora se enfrentan a una elección difícil: transformarse o desaparecer.
Gráfico reciente del rendimiento del precio de las acciones de Charles River Laboratories (CRL).
| Fecha | Precio de apertura (USD) | Precio máximo (USD) | Precio mínimo (USD) | Precio de cierre (USD) | Volumen |
|---|---|---|---|---|---|
| 2025-04-09 | 121.71 | 139.31 | 117.26 | 139.07 | 1,974,894 |
| 2025-04-08 | 136.86 | 137.96 | 122.06 | 123.61 | 1,586,299 |
| 2025-04-07 | 132.79 | 139.16 | 128.03 | 134.07 | 1,984,859 |
"Es como la transición del cine a la fotografía digital", dijo un analista. "Solo que esta vez, lo que está en juego son miles de millones en ingresos de I+D".
El camino a seguir: validación, transición y resistencia
Coordinación regulatoria e implicaciones globales
Si bien la hoja de ruta ofrece claridad, la transición está lejos de completarse. Un desafío clave será la validación: demostrar que estos nuevos métodos predicen los resultados humanos mejor que los animales, de manera consistente y en todos los tipos de fármacos.
La validación de las Nuevas Metodologías de Enfoque (NAMs) se refiere al proceso de establecer su fiabilidad y relevancia científica para un propósito específico previsto, como las pruebas de toxicidad. Esto generalmente implica adherirse a criterios científicos definidos y procesos formales, a menudo guiados por organismos reguladores como la FDA, para garantizar que el método alternativo sea adecuado para su propósito.
La FDA, en asociación con los NIH, el Programa Nacional de Toxicología y el Departamento de Asuntos de Veteranos, está organizando un taller público a finales de este año. Solicitará comentarios y perfeccionará los plazos de implementación. Un programa piloto que se lanzará este año probará la hoja de ruta en condiciones del mundo real, lo que probablemente dará forma a una guía más amplia en 2026 y más allá.
Otros organismos reguladores están observando de cerca. Si la iniciativa de la FDA tiene éxito, podría seguir una armonización global, y los reguladores europeos, canadienses y asiáticos podrían moverse para alinear los estándares, un cambio que simplificaría drásticamente el desarrollo internacional de fármacos.
Análisis de mercado: riesgo, rotación y recompensa
La tesis de inversión biofarmacéutica tras la agitación regulatoria
Desde una perspectiva de los mercados de capitales, la medida de la FDA es uno de los cambios regulatorios más trascendentales en décadas.
- Los modelos de I+D biofarmacéutica se comprimirán, con plazos que se reducen en meses, si no años.
- Los márgenes de beneficio pueden ampliarse a medida que las empresas reducen los costes asociados con los largos ciclos de pruebas en animales y los protocolos de seguridad redundantes.
- Es probable que la actividad de fusiones y adquisiciones aumente, y las CRO con conocimientos tecnológicos y las empresas de modelado de IA se conviertan en objetivos atractivos.
Crecimiento proyectado del mercado para las Nuevas Metodologías de Enfoque (NAMs) frente al pronóstico del mercado tradicional de pruebas en animales.
| Segmento de mercado | Región/Alcance | Valor del año base (aprox.) | Valor proyectado (aprox.) | CAGR (aprox.) | Período de pronóstico | Notas de la fuente |
|---|---|---|---|---|---|---|
| Pruebas alternativas no animales (NAMs) | Global | 1.110 millones de USD (2019) | - | 6,34% | 2023-2028 | Varios informes indican un crecimiento significativo, impulsado por las preocupaciones éticas y los impulsos regulatorios (por ejemplo, los principios de las 3R). Incluye métodos in vitro, in silico y de órgano en chip. |
| Pruebas alternativas no animales (NAMs) | Global | 9.800 millones de USD (2021) | 29.400 millones de USD (2030) | 13,5% | 2022-2030 | Otro pronóstico que muestra un crecimiento aún mayor, que potencialmente incluye una definición más amplia de NAMs o un alcance de mercado diferente. Enfatiza el apoyo gubernamental y la tecnología como los órganos en chip. |
| Pruebas alternativas no animales (NAMs) | Global | 1.800 millones de USD (2023) | - | 11,9% | 2024-2032 | Destaca las crecientes inversiones, las preocupaciones éticas, el apoyo regulatorio (FDA/UE) y los avances tecnológicos (órgano en chip, modelos de tejido 3D) como impulsores clave. |
| Pruebas de toxicología in vitro (componente de las NAMs) | Global | 10.990 millones de USD (2023) | 30.060 millones de USD (2033) | 10,82% | 2024-2033 | Representa una parte significativa del mercado de las NAMs, mostrando un fuerte crecimiento impulsado por el descubrimiento de fármacos, la seguridad química y la aceptación regulatoria. Múltiples fuentes muestran CAGR similares (10,8%-11,2%). |
| Mercado de organoides (tecnología NAM específica) | Global | - | 3.300 millones de USD (2027) | 21,7% | Próximos 3 años | Tecnología NAM específica que muestra un potencial de crecimiento muy alto, lo que refleja los avances en el modelado biológico complejo. |
| Pruebas tradicionales en animales | Global | 10.740 millones de USD (2019) | - | 1,03% | 2023-2028 | Muestra un crecimiento significativamente más lento en comparación con las NAMs, atribuido a las presiones éticas, la adopción de los principios de las 3R y los cambios regulatorios (por ejemplo, el objetivo de la EPA de poner fin a las pruebas en mamíferos para 2035). |
| Pruebas tradicionales en animales | Global | 10.740 millones de USD (2019) | - | 2,64% | 2028-2035 | El pronóstico indica un crecimiento ligeramente mayor en el período posterior, pero aún sustancialmente menor que las NAMs. |
| Mercado de modelos animales | Global | 1.900 millones de USD (2022) | 3.600 millones de USD (2032) | 6,6% | 2023-2032 | Este pronóstico se centra específicamente en el mercado de los animales en sí, mostrando un crecimiento moderado, probablemente impulsado por las necesidades continuas de I+D a pesar del impulso para las alternativas. |
Al mismo tiempo, el riesgo acecha a los que adoptan lentamente. "Los inversores deben ser implacablemente selectivos", dijo un gestor de fondos. "Esto no es una marea creciente. Es un cambio radical. Algunos barcos se elevarán. Otros se hundirán".
Una revolución silenciosa y humana
La decisión de la FDA de poner fin a las pruebas obligatorias en animales para los anticuerpos monoclonales es más que una actualización regulatoria. Es el comienzo silencioso de una transformación biomédica, una que promete curas más rápidas, precios de los fármacos más bajos, mejor ciencia y menos jaulas.
Y para los inversores más sofisticados del mundo, marca el comienzo de una nueva época de inversión, una que recompensa la previsión tecnológica, el liderazgo ético y la ciencia centrada en el ser humano.
En un mundo de ruido, a veces las revoluciones más significativas comienzan con el suave zumbido de un chip de silicio, que reemplaza el chirrido de una rata de laboratorio.
